Das Elektron ist eines der wichtigsten Elementarteilchen, denn es beeinflusst das Verhalten aller Atome und Moleküle im Universum. Jetzt ist es deutschen Forschern gelungen, seine Masse so genau zu bestimmen wie nie zuvor. Dies ermöglicht künftige noch präzisere Tests des physikalischen Standardmodells und könnte sogar bei der Erforschung der Dunklen Materie helfen, wie die Wissenschaftler im Fachmagazin „Nature“ berichten.
Das Elektron ist einer der Grundbausteine der Materie, denn erst dieses negativ geladene Teilchen komplettiert den positiven Atomkern zu einem Atom. Gleichzeitig hält das Elektron auch die in Molekülen verbundenen Atome zusammen und verleiht ihnen ihre typischen Eigenschaften. Das leichteste unter den elektrisch geladenen Elementarteilchen bildet zudem eine Grundlage des Standardmodells der Physik. Die Masse des Elektrons ist eine der möglicherweise fundamentalen Konstanten dieses Modells und beeinflusst zahlreiche andere Parameter.
Wie wiegt man ein Elementarteilchen?
Das Problem dabei: Die Masse des Elektrons ist so gering, dass sie mit keiner Waage der Welt direkt messbar wäre. Stattdessen muss man auf indirekte Methoden zurückgreifen. Bisher erfolgten diese Messungen meist in einer sogenannten Penningfalle. Dabei wird das Elektron in einem starken Magnetfeld eingefangen und in eine kreisförmige Bewegung versetzt. Die Merkmale dieser Bewegungen, die sogenannte Cyclotron-Frequenz, lassen sich messen und mit der von geladenen Teilchen mit bekannter Masse vergleichen.
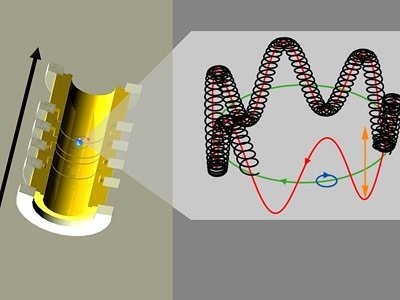
„Bei einem Formel-1-Rennen auf einem Rundkurs können Zuschauer mitzählen, wie oft ein Rennwagen vorbei rast, und mit Hilfe der Streckenlänge daraus seine Geschwindigkeit abschätzen“, erklärt Projektleiter Sven Sturm vom Max-Planck-Institut für Kernphysik in Heidelberg. So ähnlich funktioniert das auch in der Penningfalle, wobei die Physiker zusätzlich das winzige Kreiseln des Elektronenspins im Magnetfeld mit erfassen.