Wasser ist nicht gleich Wasser: Nicht alle Wassermoleküle reagieren gleich schnell und gut mit einem Reaktionspartner. Stattdessen kommt es auf die Symmetrie der Wasserstoff-Spins im H2O-Molekül an, wie ein Experiment deutscher Forscher enthüllt. Demnach reagieren Wassermoleküle schneller mit einem Partner, wenn die Spins ihrer Wasserstoffatome in entgegengesetzte Richtungen zeigen. Die beiden Wasser-Isomere unterschieden sich demnach auch in ihrer chemischen Reaktivität, so die Forscher im Fachmagazin „Nature Communications“.
So allgegenwärtig und „normal“ uns Wasser erscheint, so ungewöhnlich ist das H2O-Molekül in chemisch-physikalischer Hinsicht. Zu seinen Eigenheiten gehört die Eigendissoziation, aber auch die Dichteanomalie des Wassers – die Ausdehnung von Wassereis beim Gefrieren. Noch seltsamer aber ist die Anordnung der Wassermoleküle in flüssigem Wasser: Sie bilden – für uns unsichtbar – sogar zwei verschiedene Wasservarianten.
Auf den Spin kommt es an
Auch auf der Atomebene ist Wasser keineswegs gleich Wasser: Bei einigen H2O-Molekülen zeigen die Spins der Wasserstoffatome in die gleiche Richtung, man spricht dann von Ortho-Wasser. Beim sogenannten Para-Wasser sind die Wasserstoff-Spins dagegen entgegengesetzt ausgerichtet. Beide Isomere des Wassers kommen gemeinsam vor und stehen miteinander in einem Gleichgewicht.
Das Problem: Weil beide H2O-Isomere fast die gleichen physikalischen Eigenschaften besitzen, sind sie extrem schwer zu trennen. Das wiederum macht es schwer herauszufinden, ob und wie ihre Präsenz chemische Reaktionen beeinflusst. „Es stellt sich die Frage, ob Para- und Ortho-Wasser ein unterschiedliches chemisches Verhalten zeigen“, erklären Ardita Kilaj von der Universität Basel und ihre Kollegen.
Wasser-Isomere sortiert
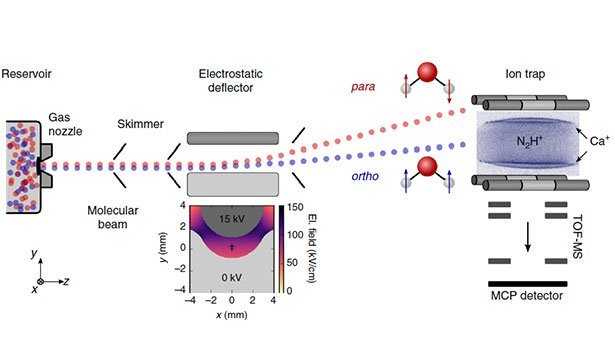
Um das herauszufinden, haben die Forscher zunächst eine Methode verfeinert, mit der sich die beiden Wasser-Isomere trennen lassen. Dabei wird ein Strahl extrem heruntergekühlter Wassermoleküle in einer Vakuumkammer durch ein elektrisches Feld geleitet. Je nach Spinsymmetrie der Wasserstoffatome werden die H2O-Moleküle dabei in einem leicht verschiedenen Winkel abgelenkt – die Isomere bilden zwei getrennte Strahlen.
Diese „vorsortierten“ Molekülstrahlen leiteten die Wissenschaftler dann in eine Ionenfalle, in der das Ortho- und Para-Wasser jeweils mit ultrakalten Diazenylium-Ionen (N2H+ reagierte. Dabei überträgt ein Diazenylium-Ion einen Wasserstoffkern auf ein Wassermolekül. Diese Reaktion ist auch aus der Chemie des Weltraums bekannt.
Para-Wasser ist schneller
Tatsächlich registrierten die Forscher Unterschiede zwischen den beiden Wasser-Isomeren: Das Para-Wasser reagierte rund 23 Prozent schneller als Ortho-Wasser. Zudem ergaben ergänzende Modellrechnungen, dass die Energiekurven der Moleküle bei dieser Reaktion beim Ortho-Wasser langsamer abfiel als beim Para-Wasser, wie Kilaj und ihre Kollegen berichten.
Aber warum? Die Antwort lieferte ein physikalisches Modell. Demnach prägt der Kernspin der beiden Wasserstoffatome auch den Drehimpuls des Gesamtmoleküls. Das wiederum beeinflusst, wie H2O und der Reaktionspartner Diazenylium aufeinandertreffen und führt zu unterschiedlich starken Anziehungskräften zwischen ihnen, wie die Forscher erklären. Para-Wasser vermag seine Reaktionspartner stärker anzuziehen als die ortho-Form, was sich in einer erhöhten chemischen Reaktivität auswirkt.
„Dieses Ergebnis unterstreicht das Wechselspiel zwischen dem Kernspin und der Rotationssymmetrie des Moleküls – und bestätigt dessen Auswirkungen auf die chemische Reaktivität“, konstatieren Kilaj und ihre Kollegen. (Nature Communications, 2018; doi: 10.1038/s41467-018-04483-3)
(Universität Basel, 30.05.2018 – NPO)