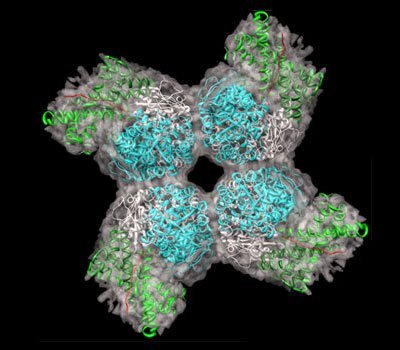
Wissenschaftlern ist es erstmals gelungen, das Kohlendioxid- bindende Schlüsselprotein der Photosynthese im Reagenzglas nachzubauen. Diese jetzt in „Nature“ veröffentlichte Errungenschaft ebnet den Weg dazu, das künstlich hergestellte Protein so zu verändern, dass es effektiver Kohlendioxid umsetzt als das Original aus der Natur und damit dem Treibhauseffekt entgegenwirkt.
Die Photosynthese ist einer der wichtigsten biologischen Prozesse. Pflanzen wandeln mit Hilfe des Sonnenlichts Kohlenstoffdioxid (CO2) und Wasser in Sauerstoff und Zucker um. Ohne diesen Prozess wäre das heutige Leben undenkbar. Somit ist das Schlüsselprotein der Photosynthese, das Forscher kurz Rubisco nennen, eines der wichtigsten Proteine überhaupt. Angesichts steigender Treibhausgaskonzentrationen in der Atmosphäre wäre Rubisco theoretisch ein wertvoller Helfer gegen den Klimawandel.
Natürliche Form heute ineffektiv
„Doch das Protein reagiert nicht nur mit CO2, sondern auch häufig mit Sauerstoff“, erklärt Manajit Hayer-Hartl, Gruppenleiterin am Max-Planck- Institut für Biochemie in Martinsried. Daher ist es in seiner natürlichen Form relativ ineffektiv. Aufgrund seiner komplexen Struktur gelang es Forschern bislang nicht, das Rubisco künstlich im Reagenzglas herzustellen und möglicherweise so zu verändern, dass es effektiver CO2 abbaut. Doch jetzt ist es den Max-Planck-Forschern erstmals gelungen, diese Hürde zu überwinden und einen solchen Komplex nachzubauen.
Dafür nutzen die Wissenschaftler die Hilfe von Chaperonen. Der Begriff Chaperon kommt aus dem Französischen und bedeutet Anstandsdame. Sie begleitet eine jüngere Dame zu einem Rendezvous und passt auf, dass der Verehrer ihrem Schützling nicht zu nahe kommt. Ähnlich arbeiten auch die molekularen Chaperone in der Zelle: Sie machen es möglich, dass nur die richtigen Teile eines frisch produzierten Proteins zueinander finden und damit die korrekte dreidimensionale Struktur erhalten.
Chaperone halfen bei Nachbau
„Bei den 16 Untereinheiten von Rubisco ist die Gefahr groß, dass sich falsche Teile des Proteins zusammenlagern und verklumpen“, erklärt die Biochemikerin Hayer-Hartl. Nur mit der richtigen Struktur kann Rubisco seine Aufgabe in der Pflanze erfüllen. Die MPI-Forscher konnten jetzt zeigen, dass zwei verschiedene Chaperone, die in der Fachsprache GroEL und GroES genannt werden, und ein weiteres Helferprotein (RbcX) nötig sind, um einen funktionierenden Rubisco-Komplex nachzubauen.
Nun wollen die Forscher das Rubisco-Protein gentechnisch so verändern, dass es häufiger CO2 fixiert und seltener Sauerstoff umsetzt. „Da das veränderte Rubisco das Treibhausgas CO2 besser aus der Atmosphäre binden wird“, so Manajit Hayer-Hartl, „könnte dies auch von Interesse für den Klimaschutz sein.“
(Max-Planck-Gesellschaft, 18.01.2010 – NPO)