Licht stimuliert Hörnerv: Forscher haben besonders schnelle „molekulare Lichtschalter“ entwickelt, die Implantate für schwerhörige und taube Menschen verbessern könnten. Diese Ionenkanäle reagieren auf Lichtpulse aus winzigen Lichtquellen. Eingeschleust in das Innenohr ermöglichen sie eine sehr präzise Stimulation der Hörnervenzellen, wie Experimente mit Mäusen zeigen. Dank dieser Technik könnten Patienten womöglich eines Tages wieder Musik genießen – das ist mit herkömmlichen Implantaten bisher nicht möglich.
Oftmals sind geschädigte Haarsinneszellen im Innenohr die Ursache für Schwerhörigkeit oder Taubheit. Diese Zellen wandeln eingehende Schallreize normalerweise in elektrische Signale um und leiten sie an den Hörnerv weiter. Von dort werden die Informationen dann an Verarbeitungsstationen im Gehirn übertragen. Sogenannte Cochlea-Implantate können defekte oder verloren gegangene Haarzellen überbrücken, indem sie den Hörnerv mithilfe kleiner Elektroden direkt stimulieren. Auf diese Weise erlangen Betroffene zumindest einen Teil ihres Hörvermögens zurück.
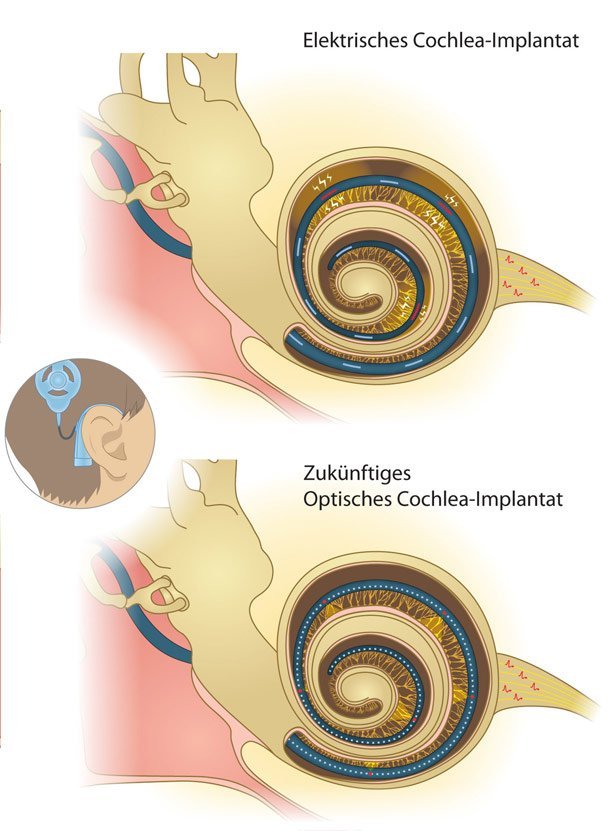
Doch es gibt ein Problem: Die implantierten Elektroden stimulieren jeweils einen großen Frequenzbereich. Das bedeutet, dass akustische Signale mit ähnlichem Frequenzgehalt nur schwer unterschieden werden können – Melodien in Sprache und Musik zum Beispiel sind daher kaum zugänglich.
Stimulation mittels Lichts
Wissenschaftler suchen deshalb schon länger nach Möglichkeiten, die Hörnervenzellen räumlich präziser zu stimulieren und damit die Unterscheidung von Frequenzen zu erleichtern. Eine vielversprechende Alternative könnten optogenetische Implantate sein, die den Hörnerv nicht elektrisch, sondern mit Lichtpulsen stimulieren. Dabei muss den Zellen im Ohr eine Art molekularer Lichtschalter eingesetzt werden, der einzelne Nervenzellen gezielt an- und ausschalten kann: ein lichtempfindlicher Ionenkanal namens Kanalrhodopsin.
Thomas Mager vom Max-Planck-Institut für Biophysik in Frankfurt und seinen Kollegen ist nun ein entscheidender Schritt hin zur Umsetzung solcher Implantate gelungen. Denn die bisher verfügbaren, ursprünglich aus einzelligen Algen stammenden Kanalrhodopsine waren für die Zellen des Hörnervs zu langsam. Das Team hat deshalb versucht, schnellere auf Licht reagierende Ionenkanäle zu entwickeln.
Schnelle Ionenkanäle
Basierend auf der Kanalrhodopsin-Struktur wandelten die Forscher mehrere Molekültypen mit unterschiedlichen Absorptionswellenlängen durch Punktmutationen zu besonders schnellen molekularen Lichtschaltern um. Je schneller die Schaltgeschwindigkeit der Ionenkanäle, desto größer ist die Rate, mit der Nervenzellen elektrische Nervenimpulse abfeuern können. Bei Tests in Zellkulturen erwiesen sich schließlich zwei durch rotes Licht anregbare Molekülvarianten als besonders vielversprechend.
Gene für diese Ionenkanäle schleusten Mager und seine Kollegen mithilfe von harmlosen Viren in das Innenohr von Mäusen ein. Es zeigte sich: Die Zellen des Hörnervs produzierten nach der Virusinjektion große Mengen der Kanalproteine. Laserblitze, die durch eine 50 Mikrometer dicke Glasfaser in die Hörschnecke geleitet wurden, lösten daraufhin elektrische Impulse im Hörnerv und im Hirnstamm der Tiere aus. Auch bei alten Tieren mit verringertem Hörvermögen zeigte das Hörsystem eine Antwort mit guter zeitlicher Auflösung, wie das Team berichtet.
Weitere Studien nötig
„Unsere Versuche mit Nervenzellen des Gehirns und des Hörnervs von Mäusen zeigen, dass die Kanäle elektrische Impulse mit einer Frequenz von bis zu 600 Hertz auslösen können. Das entspricht in etwa der maximalen natürlichen Erregungsrate – und das bei geringer Lichtintensität“, berichtet Magers Kollege Ernst Bamberg.
Durch die zeitlich präzise Stimulation der Nervenzellen und die höhere Frequenzauflösung versprechen sich die Wissenschaftler in Zukunft Implantate mit deutlich verbesserter Hörqualität. Stark schwerhörige Patienten könnten damit vermutlich Sprache selbst in lauter Umgebung verstehen und sogar Musik genießen. „Bis optogenetische Implantate in der Praxis eingesetzt werden können, sind jedoch noch weitere Studien nötig“, schließt Mitautor Tobias Moser von der Universität Göttingen. (Nature Communications, 2018; doi: 10.1038/s41467-018-04146-3)
(Max-Planck-Gesellschaft, 02.05.2018 – DAL)