In Aktion ertappt: Forscher haben erstmals direkt beobachtet, wie ein Abschnitt der „Junk-DNA“ ein Gen an- und ausschaltet. Die Echtzeit-Aufnahmen enthüllen, wie sich der DNA-Strang verbiegt, um Steuersequenz und Gen in Kontakt zu bringen und wie dann das Ablesen des Gens einsetzt. Bisher war rätselhaft, wie solche „Enhancer“ mit ihren oft weit entfernten Genen kommunizieren. Überraschend auch: Die Transkription findet nur so lange statt, wie auch Kontakt mit der Steuersequenz besteht.
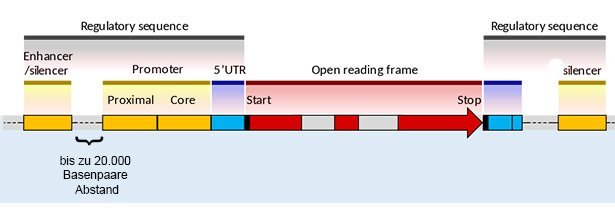
Unser Erbgut besteht nur zu zwei Prozent aus proteinkodierenden Genen – der Rest sind Genfragmente, Kopien oder DNA-Abschnitte mit unbekannter Funktion. Lange galten sie als funktionsloser DNA-Müll. Inzwischen jedoch ist klar, dass diese Junk-DNA für unser Erbgut sogar essenziell ist – sie bildet ein gewaltiges Steuerpult aus mehr als vier Millionen molekularen Schaltern.
Das Rätsel der Enhancer
Innerhalb der Junk-DNA gibt es allein 200.000 bis eine Million sogenannter Enhancer. Diese bis zu 1.500 Basenpaare langen DNA-Abschnitte sorgen erst dafür, dass die ihnen zugeordneten Gene abgelesen werden. Seltsam jedoch: Meist liegen die Enhancer im DNA-Strang weit von ihren Genen entfernt – oft trennen sie mehrere tausend DNA-Basen. Wie sie es schaffen, trotzdem ihr Gen rechtzeitig und gezielt anzuschalten, blieb daher bisher ein Rätsel.
„Trotz vieler Studien dazu im Laufe der letzten 30 Jahre ist noch immer offen, wie die Enhancer über so große genetische Entfernungen hinweg mit ihren Zielgenen kommunizieren“, sagen Thomas Gregor von der Princeton University und seine Kollegen. Das Problem: Der Blick ins Genom und auf die Enhancer war bisher nur bei präparierten und damit abgetöteten Zellen möglich. Doch damit allein lassen sich die funktionellen Zusammenhänge kaum klären.
Fluoreszenz verrät Verhalten
Das hat sich nun geändert. Denn den Forschern ist es nun gelungen, die Arbeit der Enhancer live zu beobachten. Dafür haben Gregor und sein Team fünf Enhancer und ihr Zielgen mit drei verschiedenen Fluoreszenzmarkern versehen. Ist das Gen aktiv, bewirkt es die Bildung von charakteristischen Zellstreifen am frühen Embryo der Fruchtfliege Drosophila.
„Mithilfe dieser drei Marker können wir die Annäherung von Enhancer und Gen erkennen, aber auch die Ablese-Aktivität des Gens überwachen“, erklären die Wissenschaftler. „Das gibt uns die einzigartige Chance, in Echtzeit mitzuverfolgen, wie diese beiden DNA-Regionen miteinander interagieren.“ In ihrem Experiment beobachteten sie die Veränderungen des Genschalters und seines Ziels in mehr als 7.000 Zellkernen von 84 verschiedenen Fruchtfliegen-Embryos.
Auf die Nähe kommt es an
Mit Erfolg: Die Forscher konnten beobachten, wie sich die DNA-Abschnitte von Enhancer und Gen im Zellkern annäherten. Dies geschah durch Schleifenbildung und Krümmung des DNA-Strangs. Als beide DNA-Regionen nur noch rund 340 Nanometer auseinander waren, setzte im Zielgen die Ablese-Aktivität ein – der Enhancer hatte das Gen anschaltet. „Der Wechsel von AUS zu AN ist dabei von einem scharfen Übergang der Transkriptions-Aktivität gekennzeichnet“, so Gregor und seine Kollegen.
Interessant auch: Das Zielgen blieb nur so lange angeschaltet, wie der Enhancer in engem Kontakt mit dem Gen blieb. Sobald sich der Junk-DNA-Abschnitt wieder entfernte, hörte auch das Ablesen des Gens auf. „Das spricht dafür, dass die Transkription die physikalische Nähe des Enhancers erfordert“, sagen die Forscher. Damit Gene im Erbgut abgelesen werden können, muss sich demnach erst die dreidimensionale Anordnung des DNA-Strangs verändern – quasi die Landschaft des Genoms.
Anhaltender Kontakt statt „Hit and Run“
Nach Ansicht der Forscher liefern ihre Ergebnisse wertvolle neue Einblick in die Funktionsweise unseres Erbguts. Gleichzeitig widerlegt ihr Experiment die Hypothese, nach die Aktivierung von Gene nach dem „Hit-and-Run“-Prinzip erfolgt: Ein kurzer Anstoß genügt, und schon läuft die Transkription von selbst weiter durch. Wie sich nun zeigt, ist stattdessen ein ständiger Kontakt von Enhancer und Zielgen nötig – entfernt sich der Schalter, hört auch das Ablesen sofort auf.
Hilfreich ist das neue Wissen auch für die Medizin. Denn bei vielen Krankheiten spielen Fehler oder ein falsches Timing bei der Interaktion von Enhancern und ihren Genen eine Rolle. „Der Schlüssel, um solche Erkrankungen zu heilen ist unsere Fähigkeit, die dahinterstehenden Mechanismen zu verstehen“, erklärt Gregor. (Nature Genetics, 2018; doi: 10.1038/s41588-018-0175-z)
(Princeton University, 26.07.2018 – NPO)














