Die Wirkung von Ecstasy und anderen Amphetamin-Abkömmlingen beruht auf ihrem Einfluss auf die körpereigenen Botenstoffe des Gehirns, die Neurotransmitter. Doch wie genau dieser Effekt aussieht, war bisher nur in Teilen bekannt. Jetzt haben Wissenschaftler herausgefunden, dass nicht nur ein sondern gleich zwei unterschiedliche Transportmoleküle hierbei eine entscheidende Rolle spielen.
Ecstasy bewirkt die Freisetzung von Neurotransmittern durch ein ausgeklügeltes Zusammenspiel zellulärer Komponenten: Ein Enzym bewirkt dabei, dass zwei an sich gleichartige Transportproteine gegenläufig arbeiten. Diese neue Erkenntnis steht im Kontrast zu bisherigen Annahmen, dass einzelne Transportproteine im Alleingang für die Freisetzung von Neurotransmittern durch derartige Drogen verantwortlich seien. Die aktuell veröffentlichten Ergebnisse einer Gruppe der Medizinischen Universität Wien liefern nun wichtige Grundlagen für ein besseres Verständnis der Wirkungsweise von bestimmten Neurotransmittern und Drogen.
Ecstasy, Ice und Speed sind moderne Abwandlungen der ursprünglich als Appetitzügler entwickelten Amphetamine. Auf Grund ihres Potenzials, Sucht und Schizophrenie zu verursachen, sind sie gesetzlich verboten. Sie finden aber seit Anfang der 1990er Jahre Anwendung als Modedrogen. Ihr Effekt beruht unter anderem darauf, dass ihre chemische Struktur jener von Botenstoffen des menschlichen Nervensystems ähnelt.
Paradoxe Wirkung
{2r}
Diese als Neurotransmitter bezeichneten Botenstoffe werden über zelluläre Proteine transportiert, die sich quer durch die Zellmembran erstrecken. Diese Proteine transportieren die Botenstoffe im Regelfall in die Zelle zurück, um die Signalübertragung zwischen den Nervenzellen zu beenden. Bei Proteinen, die für den Transport von Serotonin zuständig sind (SERT – Serotonin-Transporter), greifen Amphetamine auf interessante Weise in den biologischen Transportprozess ein.
Dazu die Projektleiter Prof. Harald Sitte und Prof. Michael Freissmuth vom Pharmakologischen Institut der Medizinischen Universität Wien: „Auf Grund ihrer ähnlichen Struktur konkurrieren die Amphetamine mit Neurotransmittern um den Platz an den Transportproteinen. Paradoxerweise ist es aber nicht diese Konkurrenz, die für die Wirkung der Amphetamine verantwortlich ist, sondern ein anderes, bisher wenig verstandenes Phänomen – die Amphetamine bewirken die Freisetzung von natürlichen Neurotransmittern, also eine Umkehr der Transportrichtung.“ Zur Erklärung dieses Phänomens haben nun Prof. Sitte und Prof. Freissmuth gemeinsam mit ihren KollegInnen ein viel beachtetes Modell veröffentlicht.
Zelluläres Teamwork
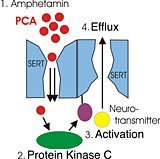
Zentraler Aspekt des Modells ist die Kooperation von zwei aneinander gebunden vorliegenden Serotonin-Transportern. Trotz Gleichartigkeit der Proteine – so das Modell – sind deren Transportrichtungen gegenläufig. Ein Umstand, dessen Ursache die Regulierung durch das zelluläre Enzym Proteinkinase C ist.
Das Modell geht davon aus, dass bei geringer Konzentration an Amphetaminen nur einer der beiden Serotonin-Transporter damit befasst ist, Amphetamine in die Zelle hineinzuschleusen. Ein Prozess, der eine Strukturänderung des Proteins erfordert. Der andere Transporter bleibt zunächst inaktiv und behält damit seine ursprüngliche Struktur. Dies erlaubt in der Folge der in der Zelle vorkommenden Proteinkinase C den Zugang zu einer wichtigen Aktivierungsstelle.
Bei dieser Aktivierung spielen die Amphetamine eine Schlüsselrolle. Dazu Prof. Sitte: „Damit die Proteinkinase C an der Aktivierungsstelle des zweiten Serotonin-Transporters wirken kann, muss das Enzym erst selbst aktiviert werden. Genau dies schafft das in die Zelle aufgenommene Amphetamin. In einer Art Kettenreaktion aktiviert die nun aktive Proteinkinase C den bis dahin inaktiven Serotonin-Transporter. Jener Transporter aber, der das Amphetamin ursprünglich in die Zelle transportiert hat, kann auf Grund seiner Strukturänderung keinen Zugang zur Aktivierungsstelle bieten und somit auch kein Serotonin hinaustransportieren. Die Wirkung der Amphetamine ist also quasi auf ein Pas de deux von zwei Proteinen angewiesen.“
Dieses international beachtete Modell steht im deutlichen Kontrast zu bisherigen Vorstellungen, dass ein und dasselbe Transportprotein sowohl Amphetamine in die Zelle hinein – als auch Neurotransmitter hinaustransportiert. Das Modell der Wiener Gruppe bietet nun neue Ansatzpunkte – zum Beispiel die Regulierung der Proteinkinase C – für optimierte Therapien von psychischen Störungen wie Depression oder Angstzuständen. Das vom FWF unterstützte Projekt ist damit ein hervorragendes Beispiel für Translational Research – das Finden neuer Anwendungsmöglichkeiten durch die Beantwortung grundlegender Phänomene.
(Medizinische Universität Wien / FWF, 22.02.2005 – DLO)